- PRODUCTS產品介紹
- Cell Culture Cell Culture
- Animal Cell Culture Animal Cell Culture
- Insect Cell Culture Insect Cell Culture
- Stem Cell Culture Stem Cell Culture
- Immune Cell Culture Immune Cell Culture
- Antibiotic/Cytokine/Growth Factor Antibiotic/Cytokine/Growth Factor
- Cell Preparation Cell Preparation
- Cell Storage/Transportion Cell Storage/Transportion
- Cell Culture Supplements Cell Culture Supplements
- Cell Dissociation & Buffer Solutions Cell Dissociation & Buffer Solutions
- Extracellular Matrix Extracellular Matrix
- Cell Isolation Cell Isolation
- Human Platelet Lysate Human Platelet Lysate
- Animal Cell Culture
- Cell Therapy Cell Therapy
- MSC
- NK
- CIK
- T Cell
- DC
- iPS
- Stem Cell-CD34 Stem Cell-CD34
- Adipose Stem Cell Adipose Stem Cell
- Water-Free Thawing System Water-Free Thawing System
- Blood biopsy preparation Blood biopsy preparation
- Quality Control Quality Control
- GMP Grade Cytokine GMP Grade Cytokine
- Common Chemicals & Buffers & Lab Tools Common Chemicals & Buffers & Lab Tools
- Life Science Life Science
- Exosome Research Exosome Research
- Spectradyne-Microfluidic Nanoparticle Analysis
- Corning-VideoDrop
- Immunostep- Lyophilized Exosome Standards
- Immunostep-ExoStep Platform
- Immunostep-Exosome Isolation Columns (SEC)
- GeneCopoeia Lentifect™ Exosome Labeling Lentiviral
- GeneCopoeia miProfile™ Exosome miRNA qPCR arrays
- Exosome Memebrane / Protein Dye
- DNA/RNA Research
- miRNA/shRNA/siRNA Research
- Protein Research
- In Vivo Assay In Vivo Assay
- Cloning & Clone Collection
- Transfection & Transduction
- IHC
- Cell-Based Assay
- Mitochondria Research Mitochondria Research
- Antibody/Antigen
- ELISA ELISA
- Antibody Labeling Antibody Labeling
- mRNA/Oligos/Nucleotide
- Microbial Research Microbial Research
- Ultra high content imaging
- Tumor Research Tumor Research
- Microarray Microarray
- Exosome Research
- Pharma Manufacturing & QC Pharma Manufacturing & QC
- Impurity Detection
- Micoplasma Detection Micoplasma Detection
- Endotoxin Remove Endotoxin Remove
- Visual Inspection Visual Inspection
- Mycobacteria Detection Mycobacteria Detection
- Nanoparticle Analyzer Nanoparticle Analyzer
- Cell Culture
- NEWS最新消息
- PROMOTIONS促銷活動
- SUPPLIER代理品牌
- AAjinomoto-iPSAbcamAbebioAbbexaAbcoreAlpha-TecAkadeum
- BBiCell ScientificBIO-HELIXBiolineBioLife SolutionsBio X Cell
- CCorningCYGNUSCompass BiomedicalCUSABIOCytori Therapeutics IncCANDOR BioscienceCreative BioMart
- DDojindo
- EExpression SystemsEastCoast BioElixirgen Scientific
- FFast Forward DiscoveriesFortius BioFisher Scientific
- GGoldBioGenlantisGeneCopoeia
- HHyTest Ltd
- IImmunostepiRealIrvine ScientificInVitriaImmuno-Biological Laboratories
- KKohjin BioKingfisher Biotech
- LList LabsLIPOSOMA ─ Clodronate Liposomes
- MMatrixome & NippiMedicagoMeridian Life Science
- NNonacus
- QQIAGEN
- PProtein ArkProFoldin-ProteomicsProSpec
- SSHIMADZUSignaGenScyTek Laboratories IncSMOBIOSpectradyne
- TTriLink BiotechnologiesTymora Analytical
- WWorthingtonWaken X BioLife Solutions
- ABOUT關於我們
- CONTACT聯絡我們
- 產品介紹
- Cell Culture Cell Culture
- Animal Cell Culture Animal Cell Culture
- Insect Cell Culture Insect Cell Culture
- Stem Cell Culture Stem Cell Culture
- Immune Cell Culture Immune Cell Culture
- Antibiotic/Cytokine/Growth Factor Antibiotic/Cytokine/Growth Factor
- Cell Preparation Cell Preparation
- Cell Storage/Transportion Cell Storage/Transportion
- Cell Culture Supplements Cell Culture Supplements
- Cell Dissociation & Buffer Solutions Cell Dissociation & Buffer Solutions
- Extracellular Matrix Extracellular Matrix
- Cell Isolation Cell Isolation
- Human Platelet Lysate Human Platelet Lysate
- Animal Cell Culture
- Cell Therapy Cell Therapy
- MSC
- NK
- CIK
- T Cell
- DC
- iPS
- Stem Cell-CD34 Stem Cell-CD34
- Adipose Stem Cell Adipose Stem Cell
- Water-Free Thawing System Water-Free Thawing System
- Blood biopsy preparation Blood biopsy preparation
- Quality Control Quality Control
- GMP Grade Cytokine GMP Grade Cytokine
- Common Chemicals & Buffers & Lab Tools Common Chemicals & Buffers & Lab Tools
- Life Science Life Science
- Exosome Research Exosome Research
- Spectradyne-Microfluidic Nanoparticle Analysis
- Corning-VideoDrop
- Immunostep- Lyophilized Exosome Standards
- Immunostep-ExoStep Platform
- Immunostep-Exosome Isolation Columns (SEC)
- GeneCopoeia Lentifect™ Exosome Labeling Lentiviral
- GeneCopoeia miProfile™ Exosome miRNA qPCR arrays
- Exosome Memebrane / Protein Dye
- DNA/RNA Research
- miRNA/shRNA/siRNA Research
- Protein Research
- In Vivo Assay In Vivo Assay
- Cloning & Clone Collection
- Transfection & Transduction
- IHC
- Cell-Based Assay
- Mitochondria Research Mitochondria Research
- Antibody/Antigen
- ELISA ELISA
- Antibody Labeling Antibody Labeling
- mRNA/Oligos/Nucleotide
- Microbial Research Microbial Research
- Ultra high content imaging
- Tumor Research Tumor Research
- Microarray Microarray
- Exosome Research
- Pharma Manufacturing & QC Pharma Manufacturing & QC
- Impurity Detection
- Micoplasma Detection Micoplasma Detection
- Endotoxin Remove Endotoxin Remove
- Visual Inspection Visual Inspection
- Mycobacteria Detection Mycobacteria Detection
- Nanoparticle Analyzer Nanoparticle Analyzer
- Cell Culture
- 最新消息
- 促銷活動
- 代理品牌
- AAjinomoto-iPSAbcamAbebioAbbexaAbcoreAlpha-TecAkadeum
- BBiCell ScientificBIO-HELIXBiolineBioLife SolutionsBio X Cell
- CCorningCYGNUSCompass BiomedicalCUSABIOCytori Therapeutics IncCANDOR BioscienceCreative BioMart
- DDojindo
- EExpression SystemsEastCoast BioElixirgen Scientific
- FFast Forward DiscoveriesFortius BioFisher Scientific
- GGoldBioGenlantisGeneCopoeia
- HHyTest Ltd
- IImmunostepiRealIrvine ScientificInVitriaImmuno-Biological Laboratories
- KKohjin BioKingfisher Biotech
- LList LabsLIPOSOMA ─ Clodronate Liposomes
- MMatrixome & NippiMedicagoMeridian Life Science
- NNonacus
- QQIAGEN
- PProtein ArkProFoldin-ProteomicsProSpec
- SSHIMADZUSignaGenScyTek Laboratories IncSMOBIOSpectradyne
- TTriLink BiotechnologiesTymora Analytical
- WWorthingtonWaken X BioLife Solutions
- 關於我們
- 聯絡我們
News
HomeNews
2024/04/25
TriLink|研究聚焦:以 mRNA 為基礎的內溶素療法


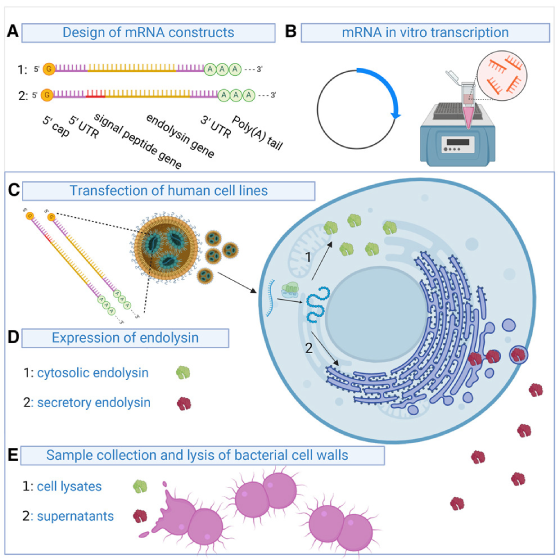
重組內溶素被視為解決抗生素耐藥危機的前景之一,因為它們可以隨著時間而不損失靈敏性的情況下溶解細菌細胞。然而,與器官靶向和生物利用度相關的挑戰限制了其治療應用。為解決這些限制,德國羅斯托克大學醫學院的研究人員利用合成的 mRNA 在人體細胞中生產 Cpl-1 內溶素。他們的研究發表於《 Molecular Therapy: Nucleic Acids》期刊上,該編碼蛋白對於肺炎鏈球菌具有活性,且其分泌變體能避免 N-linked glycosylation,對於九種臨床相關的肺炎鏈球菌株都具有活性。這項研究被認為是內溶素治療中首次採用 mRNA 技術的療法,其具有潛力用於對抗許多其他細菌病原體。
Cpl-1-encoding mRNA在人類細胞中轉譯成有活性的內溶素
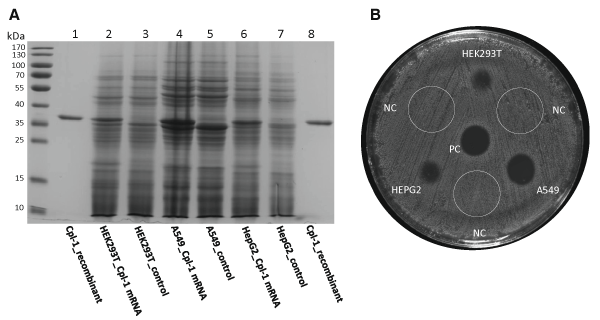
利用 HiScribe T7 mRNA Kit (New England Biolabs) 與 TriLink CleanCap® Reagent AG,從序列優化的 DNA 模板中合成 Cpl-1 mRNA。為了提高穩定性,作者將其尿嘧啶 (uridines) 替換為 N1-methylpseudouridines。使用不同量的 Cpl-1 mRNA 轉染HEK293T、A549 和 HepG2 細胞,並以 CleanCap® EGFP mRNA 做為陽性對照。在轉染後24小時,通過 Western blot 分析觀察到與 Cpl-1 對應的蛋白條帶,而未轉染的對照組則未觀察到相應條帶。並將 lysates 加到以肺炎鏈球菌 (S. pneumoniae) 接種的血琼脂平板上產生明顯的細菌溶解區域 (clear lysis zones),證實了 Cpl-1 的活性。

引入 Signal Peptide 可促使 Cpl-1 分泌
為了增加 Cpl-1 的分泌量,羅斯托克大學醫學院的研究人員設計了包含不同 Signal Peptide 的 mRNA 結構。在細胞轉染後,通過 SDS-PAGE 確認了Signal Peptide 的表達,接著進行一系列的渾濁度降低試驗,將上清液加入到肺炎鏈球菌懸浮培養物中,並隨時間測量光學密度 (OD600)。依照實驗結果選定一種以人類溶菌酶 Signal Peptide 的 mRNA 結構 (hlySP-sCpl-1) 進行進一步分析。
透過防止 N-linked glycosylation 可增強對肺炎球菌殺傷效果
N-linked glycosylation 是真核細胞分泌途徑中常見的後轉譯修飾,但會限制 Cpl-1 對肺炎鏈球菌的殺傷效果。為解決這個問題,羅斯托克大學醫學院的研究人員生成兩種具有點突變的 hlySP-sCpl-1 mRNA 結構,該突變位於 N-linked glycosylation 一致性序列上的hlySP-sCpl-1S217A 和 hlySP-sCpl-1N215D。其中,發現 hlySP-sCpl-1N215D 比 hlySP-sCpl-1S217A 對肺炎鏈球菌的殺傷效果更為顯著,進一步的研究顯示它對九株臨床相關的肺炎鏈球菌也具有效果。
結論
Trilink 特色產品
參考文獻/圖片來源>>
Jansson MK, Nguyen DT, Mikkat S, et al. Synthetic mRNA delivered to human cells leads to expression of Cpl-1 bacteriophage-endolysin with activity against Streptococcus pneumoniae. Mol Ther Nucleic Acids. 2024 Feb 8;35(1):102145.
Jansson MK, Nguyen DT, Mikkat S, et al. Synthetic mRNA delivered to human cells leads to expression of Cpl-1 bacteriophage-endolysin with activity against Streptococcus pneumoniae. Mol Ther Nucleic Acids. 2024 Feb 8;35(1):102145.